17.10.2022
Уроки 7, 8
Тема. Кавнтові властивості атома. Квантові постулати Н. Бора. Випромінювання та поглинання світла атомами.
Атомні і молекулярні спектри. Неперервний спектр світла. Спектроскоп. Спектральний аналіз та його застосування.
Завдання:
- Опрацювати теоретичний матеріал, нище за посиланням
- Записати конспект в зошит
- Відповісти на запитання в зошиті
- Записати розв'язок задач
https://www.youtube.com/watch?v=KeQkjGjvSpw
https://www.youtube.com/watch?v=CdvFAzaxuwI
Розділ 3. Квантова фізика
Ми живемо в дивному світі, у якому відбуваються різноманітні явища і процеси, які супроводжуються випромінюванням і поглинанням світла. За допомогою приладів отримуємо різноманітні спектри, на основі яких можемо визначити склад речовини планет, зірок тощо. Явище фотоефекту ми можемо використовувати у практичних цілях, що підтверджує швидке впровадження сонячних батарей у промисловості та побуті. Завдяки атомній фізиці ми отримуємо електричну енергію, яка вкрай потрібна для розвитку сучасних технологій.
Фізичну сутність таких явищ і процесів ми розглянемо в цьому розділі.
Квантові властивості світла. Постулати Бора
З 9-го класу ви знаєте, що англійський фізик Резерфорд у 1911 р. експериментально довів існування в атомі позитивно зарядженого ядра. Учений припустив, що атом складається із центрального ядра, у якому зосереджена майже вся маса атома і весь його позитивний заряд. Навколо ядра, як планети навколо Сонця, рухаються окремі електрони. Число електронів у кожному атомі таке, що їхній сумарний негативний заряд дорівнює позитивному заряду ядра, тому в цілому атом нейтральний. Ця модель будови атома отримала назву планетарна.
Дослід Резерфорда, звичайно, нічого не говорив про рух електронів. Але оскільки статична модель атома, що складається з позитивного ядра і електронів, неможлива (електрони притягнуться до позитивного ядра!), фізик припустив, що електрони рухаються навколо ядра.
Подальше вивчення планетарної моделі атома Резерфорда показало, що в рамках класичної фізики вона суперечить ряду відомих експериментальних фактів.
Перша суперечність полягає в тому, що, згідно з теорією Максвелла, будь-який електричний заряд, що рухається прискорено, повинен безперервно випромінювати електромагнітні хвилі. Електрони, які обертаються навколо ядра, рухаються з доцентровим прискоренням і, отже, повинні безперервно випромінювати електромагнітні хвилі у той час, як у нормальному стані атоми не випромінюють.
Другою суперечністю є те, що повсякденний досвід свідчить про стійкість атомів. Проте внаслідок випромінювання електромагнітних хвиль енергія електронів має безперервно зменшуватися, вони повинні наближатися до ядра і врешті-решт «впасти» на нього. Розрахунки показують, що процес «падіння» електронів на ядро має завершитися за 10-8 с. Таким чином, факт тривалого існування атомів несумісний з планетарною моделлю атома Резерфорда, якщо її розглядати з позиції класичної електродинаміки.
Ці суперечності свідчать про те, що класична електродинаміка і механіка Ньютона непридатні для пояснення явищ в атомі.
Тому видатний датський фізик Нільс Бор (1885-1962) у 1913 р. запропонував новий підхід до пояснення випромінювання світла атомами, який засновано на квантових уявленнях Макса Планка (1858-1947).
Бор залишив планетарну модель, але доповнив її положеннями, які, хоча й суперечать класичній електродинаміці Максвелла, проте відповідають дослідним даним. Ці положення назвали постулатами Бора, їх можна сформулювати так.
1. Атоми, незважаючи на те, що електрони в них рухаються з прискоренням, можуть тривалий час міститися в станах, у яких вони не випромінюють.
Ці стани отримали назву стаціонарний, або дозволений, стан.
У кожному із стаціонарних станів атом може мати тільки строго певну енергію: Е1, Е2, Е3, ... .
Цим енергіям відповідають, як виявилось, стаціонарні, або дозволені, орбіти електронів, радіуси яких відносяться як квадрати натуральних чисел: R1 : R2 : R3 : ... = 12 : 22 : 33 : ... .
2. Атом може переходити з одного стаціонарного стану в інший стаціонарний стан. Під час переходу атома з m-го стаціонарного стану з більшою енергією в n-й стан з меншою енергією атом випромінює. Частота випромінювання визначається формулою:
де h — стала Планка, h = 6,626 · 10-34 Дж · с = 4,136 · 10-15 еВ · с.
Для переходу атома зі стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією атому потрібно передати порцію (квант) енергії: E = Em - En = hv.
Стан атома, якому відповідає найменша енергія Е1, називають основним станом, а стани, яким відповідають вищі енергії (Е2, Е3, ...), — збудженими.
Існування в атомі стаціонарних станів з різними енергіями отримало блискуче експериментальне підтвердження у 1913 р. у дослідах, які провели Джеймс Франк (1882-1964) і Генріх Герц (1857-1894).
Джеймс Франк
Якщо постулати Бора справджуються, то при зіткненні з електроном атом повинен забирати енергію не від будь-яких електронів, а лише від тих, які в момент зіткнення мають кінетичну енергію, що дорівнює різниці енергій атома в двох його стаціонарних станах:
У цьому випадку зіткнення атома з електроном буде непружним. Зіткнення атома з електронами, енергія яких менша за Em - En, повинно відбуватися без передачі енергії атому (пружне зіткнення).
Якщо постулати Бора не справджуються, то зіткнення атома з електронами завжди має супроводжуватися передачею енергії.
У своїх дослідах Франк і Герц «обстрілювали» електронами атоми ртуті. Для цього з посудини, у якій була крапелька ртуті (мал. 3.1), ретельно відкачували повітря. Простір усередині трубки було заповнено в основному розрідженою парою ртуті. Джерелом електронів слугував підігрівний катод К. Прискорюючу напругу U підводили до ділянки катод К — циліндр А, що є в цьому випадку анодом. Прискорюючу напругу можна було регулювати за допомогою потенціометра R. Набута електроном в прискорюючому полі кінетична енергія дорівнює роботі поля:
Мал. 3.1
Усередині циліндра електричного поля немає, і електрони, що влітають у нього, рухаються за інерцією зі сталою швидкістю, але можуть стикатися з атомами ртуті.
Оскільки циліндр має досить велику довжину, то електрон під час руху в ньому неодмінно зазнає принаймні одного зіткнення з атомом. Для того щоб встановити, якими є зіткнення електронів з атомами — пружними або непружними, Франк і Герц застосували експериментальний метод, що отримав назву метод гальмівного поля.
Ідея цього методу полягає в такому. Якщо на електрод В, що міститься за циліндром зіткнень (мал. 3.1), названий колектором, подати невеликий (близько 0,5 В) негативний потенціал щодо циліндра, то електричне поле між циліндром зіткнень і колектором гальмуватиме рух електронів, які вилітають із циліндра. Подолати це гальмівне поле і досягти колектора можуть тільки ті електрони, кінетична енергія яких більша за 0,5 еВ.
Під час досліду виявилося, що при плавному збільшенні напруги між катодом і циліндром сила струму в колі колектора, вимірювана мікроамперметром, змінюється так, як показано на графіку (мал. 3.2).
Спочатку зі зростанням прискорюючої напруги сила струму збільшується (ділянка ОА). Це означає, що зіткнення електронів з атомами ртуті відбуваються без передачі енергії (пружні зіткнення) і електрони, які вилітають із циліндра, долають гальмівне електричне поле на ділянці циліндр-колектор. Проте при прискорюючій напрузі 4,9 В (точка А на графіку) сила струму в колі колектора різко зменшується.
Про що свідчить цей факт? При кінетичній енергії, яка сягнула значення 4,9 еВ, зіткнення електронів з атомами ртуті набули непружного характеру і атоми, забравши в електронів їхню кінетичну енергію, перейшли в новий стаціонарний стан. Електрони, що віддали повністю свою кінетичну енергію, дифундують із циліндра, але не можуть подолати гальмівне електричне поле і врешті-решт осідають на циліндр.
При подальшому збільшенні напруги між катодом і циліндром сила струму в колі колектора знову зростає. Це означає, що при енергіях, більших за 4,9 еВ, електрони, зазнавши непружних зіткнень з атомами і віддавши їм частину своєї енергії, зберігають ще достатню енергію для подолання гальмівного поля між циліндром і колектором. Наприклад, при напрузі між катодом і циліндром 6 В електрон, що влітає в циліндр, має енергію 6 еВ. Зіткнувшись з атомом ртуті, електрон віддасть атому 4,9 еВ і буде мати енергію 6 еВ - 4,9 еВ = 1,1 еВ, якої досить для подолання гальмівного поля. Тому при напругах між катодом і циліндром, більших за 4,9 В + 0,5 В = 5,4 В, сила струму в колі колектора знову зростає (ділянка ВС).
Проте при напрузі 9,8 В знову спостерігається різке зменшення сили струму в колі колектора (ділянка CD). Це спричинене тим, що за такої напруги кожен з електронів зазнає по два зіткнення з атомами і, віддавши кожному атому по 4,9 еВ, не може подолати гальмівне поле між циліндром і колектором.
При напругах, більших за 9,8 В, сила струму в колі колектора знову почне зростати (ділянка DE). Проте при напрузі 14,7 В знову спостерігатиметься зменшення сили струму в колі колектора. Це відбувається тому, що при енергії 14,7 еВ більшість електронів зазнають послідовного зіткнення з трьома атомами і, віддавши кожному по 4,9 еВ, не можуть подолати гальмівне поле.
Результати дослідів Франка і Герца підтверджують, що атоми ртуті мають стаціонарні стани і різниця енергії між двома першими енергетичними станами дорівнює 4,9 еВ: E2 - E1 = 4,9 еВ.
Експериментально було виявлено стаціонарні стани і в атомів інших елементів, а також виміряно різниці енергій між сусідніми станами. Так, виявилося, що для Калію E2 - E1 = 1,63 еВ, для Натрію — E2 - E1 = 2,12 еВ, для Гелію E2 - E1 = 21 еВ.
ЗАПИТАННЯ ДО ВИВЧЕНОГО
- 1. Укажіть основні суперечності моделі атома Резерфорда з положеннями класичної фізики.
- 2. Сформулюйте постулати Бора і поясніть, для чого їх було введено.
- 3. Намалюйте схему і поясніть хід та результати досліду Франка і Герца.
Випромінювання та поглинання світла атомами. Спектри. Спектральний аналіз та його застосування
Кольори фізичних тіл, що нас оточують, визначаються поглинанням і відбиванням певних частин спектра атомами цих тіл.
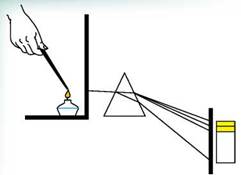
Численні дослідження довели, що внаслідок нагрівання до високої температури пара будь-якої хімічної речовини випромінює світло, вузький пучок якого розкладається призмою на кілька пучків/ліній (мал. 3.3). Сукупність цих спостережуваних ліній називають лінійчастим спектром випускання. Зазначимо, що лінійчастий спектр випускання будь-якого конкретного хімічного елемента не збігається зі спектром випускання інших хімічних елементів і, відповідно, є «візитною карткою» елемента.
Відбувається і зворотне явище: у випадку пропускання білого світла через пару речовини спостерігається виникнення темних ліній на тлі суцільного спектра. Темні лінії розташовані точно в тих місцях, де спостерігалися б світлі лінії спектра випускання цього хімічного елемента. Такий спектр називають лінійчастим спектром поглинання.
Спектри молекулярних газів відрізняються від атомних спектрів і мають вигляд системи смуг із численних і дуже близьких одна до одної ліній. Така спектральна картина пояснюється двома причинами: коливаннями атомів усередині молекули та обертанням молекули.
Енергія коливального руху молекули також підпорядковується законам квантової фізики й має дискретний ряд значень. Таким чином, один електронний енергетичний рівень розбивається на безліч коливальних підрівнів. Окрім коливань окремих частин молекули, може відбуватися обертання молекули як цілого.
У результаті електронні та коливальні рівні енергії молекули розбиваються на множину обертальних підрівнів. Кількість можливих переходів різко збільшується, що на практиці зумовлює виникнення величезної кількості ліній спектра, які зливаються в широкі смуги.
Уже зазначалося, що вимірювання спектрального випромінювання одноелементних газів дає змогу ідентифікувати склад цих газів. Якщо порівняти інтенсивність цього вимірювання зі стандартом, то за відносним рівнем випромінювання можна визначити не тільки склад, але й концентрацію елемента. Прилади, що забезпечують такі вимірювання, називають спектроскопами і спектрометрами.
Схему призматичного спектроскопа показано на малюнку 3.4. Він складається з труби коліматора Т1, трикутної призми і зорової труби Т2. Досліджуване світло, пройшовши через щілину і лінзу Л1 труби коліматора, падає на призму, у якій відбувається спектральне розкладання світла. Лінза Л2 зорової труби Т2 дає зображення спектра, яке розглядається через лінзу Л3 як через лупу. У спектрографах спектр фотографується на кольорову або високочутливу чорно-білу плівку. Для цього фотоапарат встановлюється на місце ока спостерігача.
Поставимо перед щілиною спектроскопа електричну лампу розжарення і за допомогою нього вивчатимемо випромінюване лампою світло. При незначній силі струму нитка лампи має червоний колір. У цей момент спектр випромінюваного нею світла є смужкою червоного кольору. Поступово збільшуючи силу струму, який проходить через нитку лампи, зазначаємо, що в спектрі її світла з’являється спочатку оранжева, потім жовта, блакитна, синя і фіолетова частини (мал. 3.5, 1).
Мал. 3.5
Під час фотографування спектра за допомогою спеціальних фотоапаратів на фотоплівках було виявлено, що перед областю червоного світла і за областю фіолетового світла є невидимі області спектра, що отримали відповідно назву інфрачервоної і ультрафіолетової областей.
Вивчення цих областей спектра, які не сприймає око, показало, що ультрафіолетовій області відповідають довжини хвиль у діапазоні від 1 до 380 нм, а інфрачервоній області — довжини хвиль у діапазоні від 760 нм до 1 мм. Враховуючи, що видима частина спектра лежить у межах від 380 до 760 нм, доходимо висновку, що для світла, яке випромінюється сильно нагрітим тілом, довжини хвиль лежать в інтервалі від 1 нм до 1 мм. Істотно, що в цьому інтервалі немає незайнятих проміжків, тобто спектр цього випромінювання є суцільним.
Помістимо перед щілиною спектроскопа трубку, наповнену воднем при низькому тиску (мал. 3.6). Під час під’єднання трубки до джерела високої напруги в ній відбувається електричний розряд, і з трубки випромінюється червонувате світло. Спектр цього світла складається з кількох світлих ліній на темному тлі (мал. 3.5, 7). Такий спектр отримав назву лінійчастий спектр випромінювання.
Поставивши між щілиною спектроскопа і лампою розжарювання трубку, заповнену воднем (мал. 3.7), на тлі суцільного спектра випускання нитки лампи розжарювання ми виявимо в червоній його частині кілька темних (чорних) ліній (мал. 3.5, 4). Такі спектри отримали назву лінійчасті спектри поглинання, а темні лінії — лінії поглинання. Спектри поглинання перший спостерігав Густав Кірхгоф (1824-1887).
Лінійчасті спектри утворюються, якщо світло випускається або поглинається речовиною в газуватому атомарному стані. Положення темних ліній у спектрі поглинання речовини за даної температури точно збігаються з положеннями світлих ліній у спектрі випускання цієї самої речовини за тієї самої температури. Інакше кажучи, речовина в атомарному газуватому стані за даної температури випускає і поглинає хвилі однакових частот (правило Кірхгофа).
Існують ще смугасті спектри, які складаються з окремих смуг, розділених темними проміжками. За допомогою дуже досконалого спектрального апарата можна виявити, що кожна смуга — це сукупність великої кількості щільно розміщених ліній. На відміну від лінійчастих спектрів, смугасті спектри утворюються не атомами, а молекулами, що слабо зв’язані або не зв’язані між собою.
Склад речовини може бути визначено за спектром випускання (емісійний метод) або за спектром поглинання (метод абсорбції).
Якщо в затемненому приміщенні перед щілиною спектроскопа поставити спиртівку, що горить, то побачимо суцільний спектр дуже малої яскравості. Джерелом світла, що зумовлює цей суцільний спектр, є розжарені тверді частинки в полум’ї.
Внесемо в полум’я спиртівки кристалик кухонної солі (NaCl). Зазначимо, що полум’я стане інтенсивного жовтого кольору, а в його спектрі з’являться дві дуже близько розміщені яскраві жовті лінії, що містяться в жовтій частині спектра (мал. 3.8). Те саме можна спостерігати, якщо замість кухонної солі внести до полум’я спиртівки кристалик глауберової солі (Na2SO4), йодиду натрію (NaJ), сульфіду натрію (Na2S) або карбонату натрію (Na2CO3). Будь-яка сіль натрію, введена в полум’я спиртівки, робить його жовтого кольору, у жовтій частині спектра з’являються дві яскраві, близько розташовані жовті лінії. Інакше кажучи, характерною межею натрію є те, що його розжарена пара дає спектр, у якому завжди присутні дві яскраві лінії в жовтій частині спектра.
Якщо через пари натрію, які містяться в скляній трубці, пропустити електричний струм, то ця пара світитиметься жовтим кольором. У спектрі цього випромінювання також будуть присутні вказані вище дві жовті лінії. У 1860 р. німецькі вчені Густав Кірхгоф і Роберт Бунзен (1811-1899), вивчаючи спектри металів, встановили, що кожен метал у пароподібному стані має свій характерний лінійчастий спектр. Введення в полум’я пальника будь-якої солі того самого металу завжди приводить до появи однакового лінійчастого спектра випускання.
Окремі лінії у спектрах різних елементів можуть випадково збігатися, але в цілому спектр кожного елемента є його постійною і строго індивідуальною характеристикою.
З’ясувалося, що коли вносять до полум’я суміш солей різних металів, у спектрі одночасно з’являються всі характерні для цих металів лінії. Яскравість спектральних ліній залежить від концентрації елемента в суміші речовин.
Так було відкрито новий метод визначення хімічного складу речовини — спектральний аналіз.
Спектральним аналізом називають метод визначення хімічного складу складних речовин, що ґрунтується на вивченні лінійчастих спектрів цих речовин.
Виявлення в спектрі досліджуваного зразка нових, незнайомих ліній означало, що у зразку присутні домішки невідомих у той час елементів. За допомогою спектрального аналізу було відкрито спочатку Рубідій і Цезій, а потім Талій, Індій, Галій. Усього методом спектрального аналізу було відкрито 24 хімічних елементи.
Йозеф Фраунгофер
Якщо сфотографувати спектр сонячного світла, отриманий за допомогою якісного спектроскопа, то на знімку будуть спостерігатися чіткі лінії поглинання (мал. 3.9). Уперше ці лінії описав німецький фізик Йозеф Фраунгофер (1787-1826), тому вони отримали назву — лінії Фраунгофера. Поява цих ліній пов’язана з проходженням сонячного світла через атмосферу Сонця і частково з проходженням через атмосферу Землі. Таким чином, лінії Фраунгофера — це спектр поглинання.
Зіставляючи лінії Фраунгофера з лініями випромінювання різними елементами, можна встановити, які елементи входять до складу атмосфери Сонця. Зокрема, цим методом було вперше виявлено в атмосфері Сонця елемент Гелій. Пізніше Гелій виявили і на Землі.
Спектральний аналіз за спектрами поглинання використовують коли вивчають хімічний склад речовин. Для проведення спектрального аналізу абсорбції досліджувану речовину спалюють у полум’ї, світло від якого прямує в спектроскоп або спектрограф. Одночасно через полум’я пропускають світло від еталонної спектральної трубки. Якщо в спектрі з’являться лінії поглинання, то це свідчить про речовину, що міститься в спектральній трубці досліджуваної речовини.
Спектральний аналіз має над хімічним аналізом такі переваги: висока чутливість, швидкість, простота визначення і невелика маса речовини, потрібної для його проведення.
Чутливість спектрального аналізу дуже висока: з його допомогою можна виявити елемент, домішка якого в речовині становить усього одну мільйонну частку відсотка. За сприятливих умов вдається виявити речовину, яка міститься в пробі масою 10-6 г.
Швидкість спектрального аналізу значно більша за швидкість хімічного аналізу. Тому спектральний аналіз застосовують як експрес-аналіз у металургії, у криміналістиці. Для проведення спектрального аналізу потрібно кілька десятків мікрограмів речовини. Величезне значення спектрального аналізу полягає в тому, що його можна провести, не вступаючи в безпосередній контакт з досліджуваною речовиною: у спектральному аналізі досить проаналізувати світло, яке досліджувана речовина випускає або поглинає.
Спектральний аналіз є найважливішим джерелом інформації про більшість космічних об’єктів. За допомогою цього методу можна встановити якісний і кількісний хімічний склад світила, його температуру, наявність магнітного поля, швидкість руху тощо.
ЗАПИТАННЯ ДО ВИВЧЕНОГО
- 1. Чим відрізняється молекулярний спектр від атомного?
- 2. Накресліть схему спектроскопа і поясніть принцип його роботи.
- 3. Як можна отримати суцільний і лінійчастий спектри?
- 4. Який спектр називають смугастим?
- 5. Сформулюйте правило Кірхгофа.
- 6. Назвіть основні переваги спектрального аналізу над хімічним.
Розкрийте роль спектрального аналізу в астрономічних дослідженнях.
РОЗВ’ЯЗУЄМО РАЗОМ
1. Атом випромінив фотон. Чи змінилася від цього швидкість атома? Розв’язання
2. З’ясуйте, який спектр і чому виникне в газі при рекомбінаціях позитивних йонів з вільними електронами.
Відповідь. Суцільний. Не зв’язані з атомом електрони до рекомбінації можуть мати будь-яку кінетичну енергію. Рекомбінуючи, вони випромінюють фотони найрізноманітніших енергій — суцільний спектр.
3. Спектр рентгенівського випромінювання за будь-яких напруг у короткохвильовій частині різко обривається. Поясніть цю особливість.
Розв’язання












Немає коментарів:
Дописати коментар